Remdesivir ist das erste Medikament gegen Covid-19, das unter Auflagen in Europa zugelassen wurde. Sein Wirkstoff soll die rasante Vermehrung des SARS-CoV-2-Erregers in menschlichen Zellen unterdrücken, indem er die Kopiermaschine des Virus, die RNA-Polymerase, stoppt.
Forschungsgruppen vom Göttinger Max-Planck-Institut (MPI) für biophysikalische Chemie und der Universität Würzburg haben nun geklärt, wie Remdesivir die virale Kopiermaschine bei der Arbeit stört und warum es sie nicht vollständig hemmt. Ihre Ergebnisse erklären, warum das Medikament eher schwach gegen das neue Coronavirus wirkt. Veröffentlicht sind die Resultate im Fachjournal Nature Communications.
„Nach komplizierten Untersuchungen kommen wir zu einem einfachen Schluss“, sagt Max-Planck- Direktor Patrick Cramer: „Remdesivir behindert zwar die Polymerase in ihrer Arbeit, aber erst mit einiger Verzögerung. Und das Medikament stoppt das Enzym nicht vollständig.“
Remdesivir täuscht die Kopiermaschine
Cramers Team am Göttinger MPI hatte zu Anfang der Pandemie geklärt, wie das neue Coronavirus sein RNA-Erbgut verdoppelt –für den Erreger ist das eine echte Mammutaufgabe. Denn seine RNA besteht aus einer Kette von rund 30.000 Bausteinen und ist damit besonders lang.
Um den Wirkmechanismus von Remdesivir aufzuklären, arbeitete Cramers Team mit der Gruppe von Claudia Höbartner zusammen, die spezielle RNA-Moleküle für die Struktur- und Funktionsuntersuchungen herstellte. „Remdesivir ähnelt in seiner Struktur RNA-Bausteinen“, erklärt Höbartner, Professorin für Chemie an der Universität Würzburg. Die Polymerase lässt sich davon in die Irre führen und baut die Substanz in die wachsende RNA-Kette ein.
Kopiervorgang wird pausiert statt blockiert
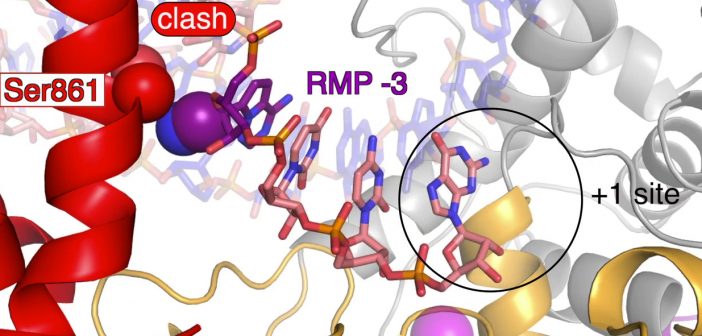
Nach dem Einbau von Remdesivir in das Virus-Erbgut untersuchten die Forscher die Polymerase- RNA-Komplexe. Wie sie herausfanden, pausiert der Kopiervorgang genau dann, wenn sich die RNA- Kette nach Einbau von Remdesivir um drei weitere RNA-Bausteine verlängert hat.
„Einen vierten Baustein lässt die Polymerase nicht mehr zu. Das liegt an nur zwei Atomen in der Struktur von Remdesivir, die sich an einer bestimmten Stelle der Polymerase verhaken. Allerdings blockiert Remdesivir die RNA-Produktion nicht komplett. Oft arbeitet die Polymerase nach einer Fehlerkorrektur auch weiter“, erläutert Goran Kokic, wissenschaftlicher Mitarbeiter in Cramers Labor. Gemeinsam mit den anderen Erstautoren der Studie, Hauke Hillen, Dimitry Tegunov, Christian Dienemann und Florian Seitz, führte er die entscheidenden Experimente durch.
Hemmung der Kopiermaschine verbessern
Zu verstehen, wie Remdesivir wirkt, eröffnet der Wissenschaft neue Chancen, das Virus zu bekämpfen. „Jetzt, da wir wissen, wie Remdesivir die Corona-Polymerase hemmt, können wir daran arbeiten, die Substanz und ihre Wirkung zu verbessern. Darüber hinaus wollen wir nach neuen Substanzen fahnden, die die virale Kopiermaschine stoppen“, so Max-Planck-Direktor Cramer.
Die inzwischen angelaufenen Impfungen seien essenziell, um die Pandemie unter Kontrolle zu bringen. “Aber wir müssen weiterhin auch wirksame Medikamente entwickeln, die im Fall von Infektionen den Krankheitsverlauf von Covid-19 mildern.“
Quelle und Publikation:
Goran Kokic*, Hauke Sven Hillen*, Dimitry Tegunov*, Christian Dienemann*, Florian Seitz*, Jana Schmitzova, Lucas Farnung, Aaron Siewert, Claudia Hoebartner, Patrick Cramer: Mechanism of SARS-CoV-2 polymerase inhibition by remdesivir. Nature Communications 12, 279 (2021), doi: 10.1038/s41467-020-20542-0 (* gleichwertiger Beitrag)
Kontakt
Prof. Dr. Patrick Cramer, Max-Planck-Institut für biophysikalische Chemie, Göttingen, T +49 551 201- 2800, patrick.cramer@mpibpc.mpg.de
Prof. Dr. Claudia Höbartner, Institut für Organische Chemie, Universität Würzburg, T +49 931 31- 89693, claudia.hoebartner@uni-wuerzburg.de